Все о бисульфитной конверсии
Обзор методики бисульфитной конверсии
Перед
выполнением бисульфитной конверсии ДНК необходимо учитывать ряд фактов, чтобы
обеспечить оптимальную производительность и последующую точность анализа
метилированной ДНК. Обработка бисульфитом по своей сути является жестким
процессом, который резко меняет как химический состав, так и физические
свойства ДНК.(Для конверсии можно использовать наборы D5001, D5005, D5020, D5030)
Исходная ДНК трансформируется из большой стабильной двухцепочечной молекулы в
набор случайных одноцепочечных фрагментов, в которых почти все цитозины
полностью заменены на урацил. Такие изменения существенно влияют на
количественное определение, оценку качества, амплификацию и анализ ДНК,
обработанной бисульфитом. Эти факты их следствия, оказывающие влияние на
УФ-спектрофотометрию (NanoDrop), электрофорез в агарозном геле и ПЦР, описаны
ниже.
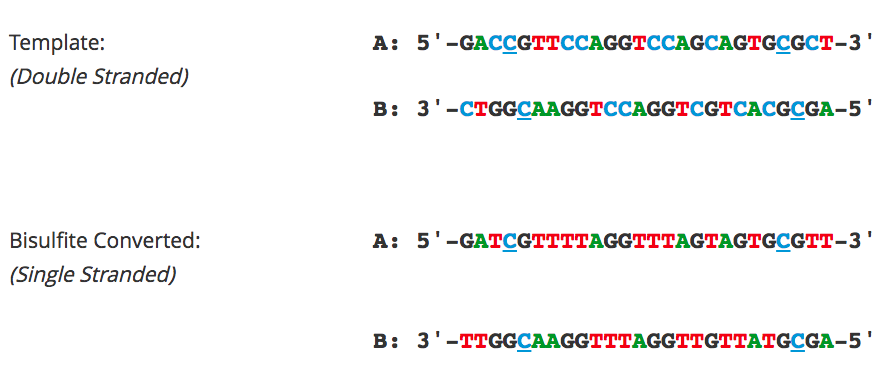
Определение количества ДНК,
обработанной бисульфитом
Конвертированная ДНК измеряется с помощью УФ-спектрофотометра (например, NanoDrop) как РНК, при Ab260 нм 1,0 = 40 мкг/мл. При определении количества полученной ДНК после бисульфитной конверсии необходимо учитывать два основных фактора: 1) целостность исходного материала и 2) загрязнение молекулами РНК.
Размер ДНК,
используемой в качестве исходного материала для бисульфитной конверсии,
является наиболее важным фактором при оценке полученной ДНК после обработки
бисульфитом. Деградированный исходный материал приведет к увеличению потерь
пробы в процессе конверсии. А загрязнение молекулами РНК будет мешать
в процессе измерения абсорбции при Ab260 нм, что приведет к завышению итогового
количества ДНК. Молекулы РНК, попадающие в реакционную смесь, деградируют,
поэтому выход ДНК после реакции оказывается низкими по сравнению с исходным
количеством. Важно отметить, что сам процесс конверсии не нарушается ни в одном
из вышеперечисленных случаев.
Оценка качества ДНК, обработанной
бисульфитом
Для
определения качества конверсии и фрагментации можно использовать электрофорез ДНК
в агарозном геле (2% гель с маркером 100 п.н., например 31032) после обработки бисульфитом.
Чаще всего после электрофореза в геле ничего не видно, это нормально и является
результатом того, что после конверсии ДНК почти полностью становится
одноцепочечной. Охлаждение геля в течение нескольких минут на ледяной бане
вызовет спаривание оснований, достаточное для интеркаляции бромистого этидия (или
других красителей, например от компании Biotium 41002, 41004), чтобы ДНК стала
видимой. Конвертированная ДНК будет видна в виде характерных шмеров в диапазоне
от 100 до 1500 п.н. Важно, чтобы в гель было внесено достаточно материала для
визуализации, обычно это около 100 нг/лунку.
Бисульфитная ПЦР и дизайн праймеров
Бисульфитная
ПЦР - это наиболее распространенный метод, используемый для анализа
метилирования ДНК, обработанной бисульфитом, но и наиболее подверженный
ошибкам. Стоит иметь в виду, что ДНК становится фрагментированной, поскольку
цепи больше не комплементарны и почти полностью лишены цитозина. Дизайн
праймеров является критическим этапом для проведения корректной бисульфитной
ПЦР.
В отличие
от обычной ПЦР, праймеры для бисульфитной ПЦР должны быть длинными (обычно от
26 до 30 оснований), а размер ампликона должен быть относительно коротким (от
150 до 300 п.н.). В идеале праймеры не должны содержать сайтов CpG, однако,
если они необходимы, их следует расположить на 5'-конце праймера со случайным
основанием в положении цитозина. Также важно отметить, что только одна цепь
преобразованной бисульфитом матрицы будет амплифицирована любым данным набором
праймеров. Фактически только обратный праймер будет связываться с исходной ДНК,
которая, в свою очередь, будет генерировать матрицу для отжига прямого
праймера. Обычно для успешной амплификации требуется от 35 до 40 циклов.
Настоятельно рекомендуются полимеразы горячего старта (например, E2001 ZymoTaq DNA Polymerase),
поскольку ДНК, обработанная бисульфитом, часто подвергается неспецифической
амплификации за счет увеличения количества АТ-пар. Средние значения температуры
отжига праймеров от 55 до
Для
удобства Zymo Research разработали программу для дизайна праймеров.
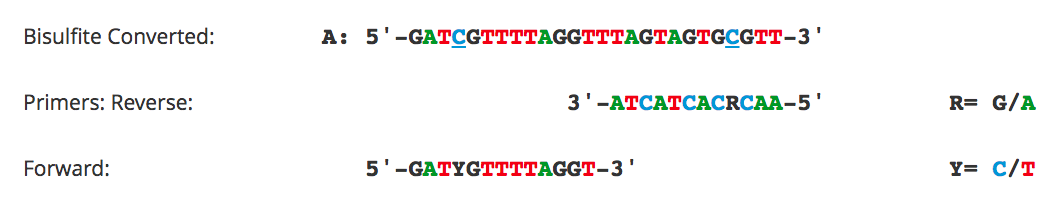
Дизайн праймеров для
метилированно-специфической ПЦР
Метилированно-специфическая
ПЦР (MSP) основана на амплификации ДНК для оценки статуса метилирования в
конкретных сайтах CpG. Успех этой методики зависит от дифференциальной
амплификации матрицы с использованием наборов метилированных (M) и
неметилированных (U) праймеров. Хотя большинство рекомендаций для дизайна таких
праймеров идентичны таковым для бисульфитной ПЦР, окружение сайтов CpG внутри
праймера должно быть совершенно другое. Для MSP необходимо размещать сайты CpG
на 3'-конце праймеров с цитозинами в метилированных (M) праймерах и тиминах в
неметилированных (U) праймерах.
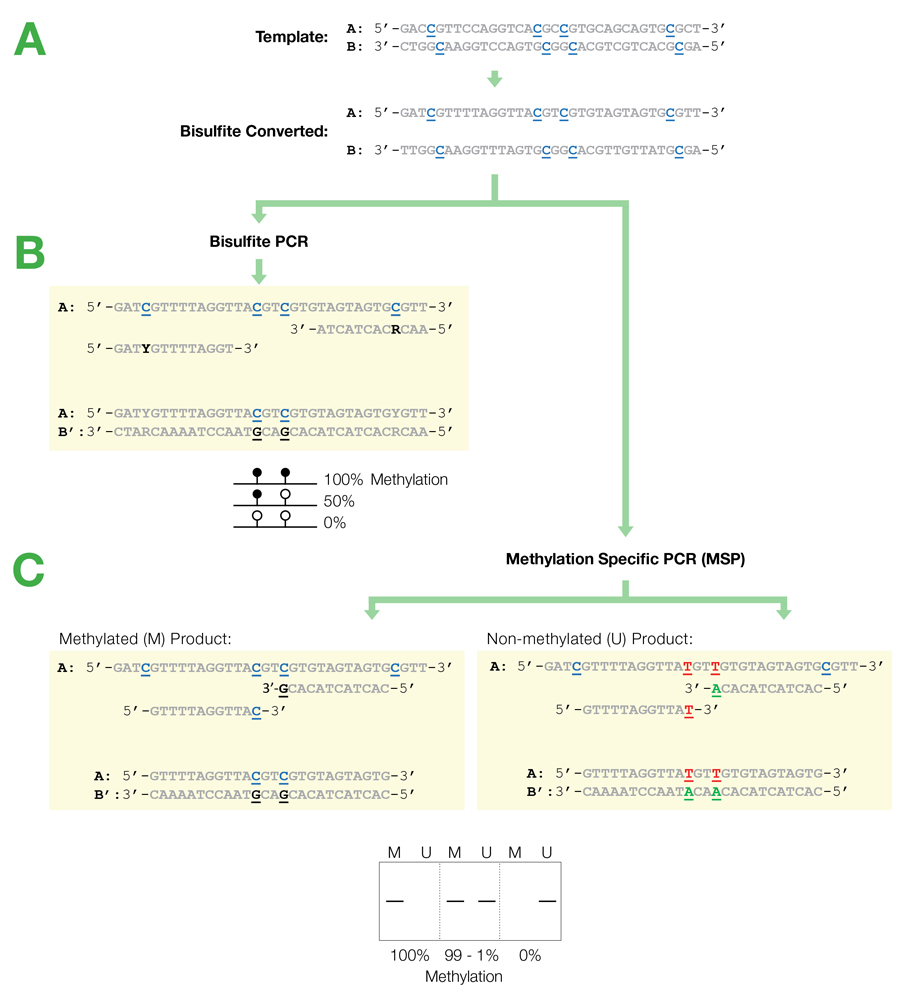
Блок-схема
дизайна праймеров для бисульфитной ПЦР и метилированно-специфической ПЦР.
А. После обработки бисульфитом две
цепи ДНК более не являются комплиментарными. Важно отметить, что только одна
цепь амплифицируется любым данным набором праймеров. Это видно на следующих
примерах:
B: праймеры для бисульфитной ПЦР
создаются для последующего секвенирования и анализа цитозинов в пределах
ампликона. Сайтов CpG в праймерах быть не должно или они должны располагаться на
С: Праймеры для
метилированно-специфической ПЦР(MSP) создаются для определения и оценки статуса
метилирования в определенных сайтах CpG. В этом случае праймеры должны
содержать CpG сайты на 3’-конце для увеличения специфичности к метилированным и
неметилированным матрицам. Полностью метилированные и неметилированные матрицы
после MSP дадут один ампликон при использовании соответствующего набора
праймеров. Образцы, содержащие и метилированные, и неметилированные сайты,
будут амплифицироваться обоими наборами праймеров.
Бисульфитное секвенирование
Бисульфитное
секвенирование по-прежнему является одним из наиболее распространенных методов,
которые применяются для анализа конвертированной ДНК, и оно обеспечивает
разрешение до одного основания по всему ампликону. Для получения наилучших
результатов и количественной оценки метилирования рекомендуется провести клонирование
и последующее секвенирование с помощью вектор-специфических праймеров. Прямое
секвенирование бисульфитных продуктов ПЦР не рекомендуется, поскольку оно дает
низкое качество результатов и затрудняет количественную оценку частично
метилированных сайтов. Пиросеквенирование можно использовать как альтернативу
прямому секвенированию.
Бисульфитное секвенирование
следующего поколения
Методики, основанные на секвенировании следующего поколения (NGS), такие как бисульфитное секвенирование ограниченного набора геномных локусов (RRBS, рекомендуем набор D5460 Zymo-Seq RRBS Library Kit) и полногеномное бисульфитное секвенирование (WGBS, рекомендуем D5465 Zymo-Seq WGBS Library Kit), все чаще используются для анализа полногеномного метилирования ДНК с разрешением до одного нуклеотида для выявления предполагаемых биомаркеров. В обеих методиках эффективность бисульфитной конверсии имеет первостепенное значение, поскольку даже относительно небольшие отклонения в эффективности могут повлиять на тысячи отдельных сайтов. Если подготовка библиотеки должна проводиться до бисульфитной конверсии, необходимо чтобы адаптеры, добавленные к фрагментированной ДНК, были метилированы для сохранения их последовательности. Также рекомендуется использовать соответствующие контрольные ДНК, если возможно метилирование в сайтах отличных от CpG (например, у растений), а также для оценки невозможности бисульфитной конверсии различать метилированную (5-mC) и гидроксиметилированную(5-hmC) ДНК.
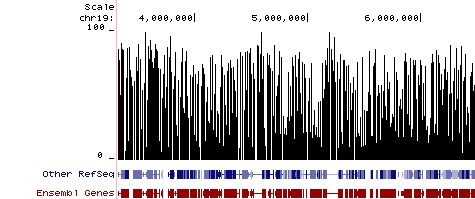
Результаты метилирования после
бисульфитного секвенирования ограниченного набора геномных локусов (RRBS).
Данные показывают относительный процент метилирования отдельных сайтов CpG ДНК
мыши. Процент метилирования показан в области ~ 3 Мб хромосомы 19 мыши.
Библиотеки для бисульфитного секвенирования были подготовлены с использованием
геномной ДНК мыши, очищенной с помощью набора Genomic Clean & Concentrator
(D4010, D4011 - Zymo Research), и бисульфитной конверсии с помощью технологии
метилирования ДНК EZ DNA Methylation перед проведением секвенирования NGS.
Похожие статьи
Эпигенетика
Эпигенетика это наука об
изменениях в экспрессии генов, вызванных механизмами, не затрагивающими
последовательность ДНК. Но что именно это означает?
Метилирование ДНК
Знаете ли вы, что количество объятий, которые ребенок получает в детстве, может повлиять на профиль метилирования ДНК ребенка и на процесс развития? Фактически, метилирование ДНК влияет на различные аспекты повседневной жизни, о которых большинство людей даже не подозревает...